ÇÖZELTİLER
İÇİNDEKİLER
•
Karışım
nedir?
•
Karışım
çeşitleri ve homojen karışım çeşitleri
•
Çözelti
nedir?
•
Çözelti
çeşitleri
•
Alaşımlar
İki
veya daha fazla maddenin özeliklerini kaybetmeden çeşitli oranlarda karışması
ile oluşan madde topluluğuna karışım denir. Örneğin ;
Şeker + Su = Şekerli su
Tuz + Su = Tuzlu su
Şeker + Su = Şekerli su
Tuz + Su = Tuzlu su
ÇEŞİTLERİ
a-Homojen karışımlar
b-Heterojen karışımlar
a-Homojen karışımlar
b-Heterojen karışımlar
Özellikleri
her yerinde aynı olan karışımlara homojen karışımlar denir. Homojen karışımlarda
ikiye ayrılır:
a-Çözeltiler
b-Alaşımlar
a-Çözeltiler
b-Alaşımlar
Ç Ö Z E L T İ L E R
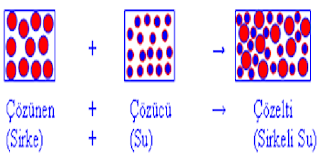
Bir maddenin başka bir madde içinde gözle görülmeyecek kadar küçük parçacıklar halinde bulunmasıyla oluşan homojen karışımlardır. Örneğin;
Şeker + su = Şekerli su
Tuz + su = Tuzlu su
Elemanları
a-çözünen madde ( şeker , tuz )
b-çözücü madde ( Su )
Bir maddenin başka bir madde içinde gözle görülmeyecek kadar küçük parçacıklar halinde bulunmasıyla oluşan homojen karışımlardır. Örneğin;
Şeker + su = Şekerli su
Tuz + su = Tuzlu su
Elemanları
a-çözünen madde ( şeker , tuz )
b-çözücü madde ( Su )
A-ÇÖZÜNEN MADDE MİKTARINA GÖRE ÇÖZELTİLER
1-Seyreltik
çözeltiler ( çözüneni az çözücü madde miktarı fazla olan çözeltiler )
( şekeri az suyu fazla olan çözeltiler )
( şekeri az suyu fazla olan çözeltiler )
2-Derişik
çözeltiler (çözüneni fazla çözücü madde miktarı az olan çözeltiler )
(şekeri fazla suyu az olan çözeltiler )
(şekeri fazla suyu az olan çözeltiler )
Seyreltik
çözeltiler derişik çözeltiye dönüştürülürken
1-Çözücü ısıtılarak buharlaştırılıp uzaklaştırılarak,
2-Çözünen madde miktarı artırılarak
B-ÇÖZÜNÜRLÜĞÜNE GÖRE ÇÖZELTİLER
1-Doymuş çözelti
2-Doymamış çözelti
C-ÇÖZEN VE ÇÖZÜNEN MADDE TÜRLERİNE GÖRE ÇÖZELTİLER
1- katı - katı çözeltiler ALAŞIMLAR
2- katı – sıvı çözeltiler Şekerli su
3- sıvı - sıvı çözeltiler Alkollü su
4- sıvı - gaz çözeltiler Gazoz , kola
5- gaz - gaz çözeltiler Hava
D-İLETKENLİKLERİNE GÖRE ÇÖZELTİLER
1-İletken ( Elektrolit ) çözeltiler
2-Yalıtkan ( Elektrolit olmayan ) çözeltiler
ÇÖZELTİLERİN ÖZELLİKLERİ
1-Homojendirler
2-Saydamdırlar
3-Tanecikleri gözle görülmez
4-Çökelti vermez
5-Süzgeç kağıdında tortu bırakmaz
A L A Ş I M L A R
1-Çözücü ısıtılarak buharlaştırılıp uzaklaştırılarak,
2-Çözünen madde miktarı artırılarak
B-ÇÖZÜNÜRLÜĞÜNE GÖRE ÇÖZELTİLER
1-Doymuş çözelti
2-Doymamış çözelti
C-ÇÖZEN VE ÇÖZÜNEN MADDE TÜRLERİNE GÖRE ÇÖZELTİLER
1- katı - katı çözeltiler ALAŞIMLAR
2- katı – sıvı çözeltiler Şekerli su
3- sıvı - sıvı çözeltiler Alkollü su
4- sıvı - gaz çözeltiler Gazoz , kola
5- gaz - gaz çözeltiler Hava
D-İLETKENLİKLERİNE GÖRE ÇÖZELTİLER
1-İletken ( Elektrolit ) çözeltiler
2-Yalıtkan ( Elektrolit olmayan ) çözeltiler
ÇÖZELTİLERİN ÖZELLİKLERİ
1-Homojendirler
2-Saydamdırlar
3-Tanecikleri gözle görülmez
4-Çökelti vermez
5-Süzgeç kağıdında tortu bırakmaz
A L A Ş I M L A R
Metallerin ısıtılıp eritilerek birbirlerine karıştırılmasıyla oluşan homojen karışımlardır.
Bakır + Kalay ------------> TUNÇ ( BRONZ )
Bakır + Altın ------------>BİLEZİK
Bakır + Çinko ------------>PİRİNÇ
Kurşun + Kalay ------------>LEHİM
Krom + Nikel + Karbon + Demir ------------>ÇELİK
ÇÖZÜNME OLAYI NASIL OLUR?
Çözünme Olayı:
Çözücü ve çözünen maddelerin birbiri içerisinde iyonlarına veya moleküllerine kadar ayrılmasına çözünme denir. Bir maddenin moleküllerinin veya iyonlarının, diğer maddenin moleküllerinin veya iyonlarının arasına girmesine çözünme denir. Çözünme olayında; • Çözücü ve çözünen maddeleri oluşturan tanecikler yani moleküller veya iyonlar çözünme olayı gerçekleşmeden önce birbirlerine çok yakındır. • Çözücü maddelerin tanecikleri ile çözünen maddelerin tanecikleri yani molekülleri veya iyonları etkileşir. • Çözünme olayında, çözücü ve çözünen maddenin tanecikleri yani molekülleri veya iyonları arasında elektron alış verişi veya ortaklaşması gerçekleşmediği için çözücü ve çözünen madde sadece fiziksel değişime uğrar, kimyasal değişime uğramaz ve maddelerin kimliklerinde değişme meydana gelmez. |
Çözünme
sonrasında, çözücü ve çözünen tanecikleri birbirlerinin etrafını sardığı için
çözücü ve çözünen tanecikleri çözeltinin her tarafında eşit miktarda bulunur.
• Çözücü madde tanecikleri, çözünen madde taneciklerinin etrafını sardığı için çözücü maddenin tanecikleri de birbirinden ayrılır.
•
Çözünen madde moleküler yapılı ise, çözücü maddenin molekülleri, çözünen
maddenin moleküllerinin arasına girerek çözünen maddenin moleküllerinin
etrafını sarar ve çözünen maddenin moleküllerine kadar ayrılmasını sağlar.
Ayrılan moleküller çözücünün her tarafına eşit oranda dağılır.
• Çözünen madde iyonik yapılı ise, çözücü maddenin molekülleri, çözünen maddenin (+) ve (–) iyonlarının arasındaki iyonik bağı zayıflatır ve (+) ve (–) iyonlar birbirinden ayrılır. Çözücü maddenin molekülleri, ayrılan (+) ve (–) iyonların arasına girerek bu iyonların etrafını sarar ve çözünen maddenin iyonlarına kadar ayrılmasını sağlar. Ayrılan iyonlar çözücünün her tarafına eşit oranda dağılır.
Örnekler
:
1- Su – sirke çözeltisinde, çözünen olan sirke, moleküler yapılı maddedir. Çözücü olan su molekülleri, çözünen olan sirke moleküllerinin etrafını sararak sirke moleküllerinin birbirinden uzaklaşmasını yani çözünmesini sağlar.
1- Su – sirke çözeltisinde, çözünen olan sirke, moleküler yapılı maddedir. Çözücü olan su molekülleri, çözünen olan sirke moleküllerinin etrafını sararak sirke moleküllerinin birbirinden uzaklaşmasını yani çözünmesini sağlar.
2- Su – şeker çözeltisinde, çözünen olan şeker, moleküler yapılı maddedir.Çözücü olan su molekülleri, çözünen olan şeker moleküllerinin etrafını sararak şeker moleküllerinin birbirinden uzaklaşmasını yani çözünmesini sağlar.
3-
Su – tuz çözeltisinde, çözünen olan tuz iyonik yapılı maddedir. Çözücü olan su
molekülleri, çözünen olan tuz bileşiğindeki (+) ve (–) iyonlar arasındaki
iyonik bağı zayıflatır ve (+) yüklü Na
iyonu ile (–) yüklü Cl iyonlarının arasına girerek bu iyonların birbirinden
ayrılmasını yani çözünmesini sağlar.
Çözünme
Hızına Etki Eden Faktörler :
-Sıcaklık
-Tanecik
Boyutunu Küçültme
-Sallama,
Karıştırma
- Basınç
Artışı
-Çözücü
Miktarı
f) -Çözünen
MiktarıÇözünme Miktarına (Çözünürlüğe) Etki Eden Faktörler :
- Sıcaklık- Basınç- Çözücünün Cinsi
- Çözünenin Cinsi
-Sallama, Karıştırma
- Sıcaklık- Basınç- Çözücünün Cinsi
- Çözünenin Cinsi
-Sallama, Karıştırma
f) -Tanecik
Boyutunu Küçültme
 |
| SIVI-SIVI ÇÖZELTİLER |
 |
| KATI-SIVI ÇÖZELTİLER |
 |
| SIVI-GAZ ÇÖZELTİLER |



Hiç yorum yok:
Yorum Gönder